17年高考化学一轮复习氢氧化亚铁的实验制备
编辑:sx_liujy
2016-09-15
氢氧化亚铁化学式Fe(OH)2,分子量89.866,白色固体,极微溶于水,下面是氢氧化亚铁的实验制备,精品学习网请考生掌握。
因Fe(OH)2在空气中易氧化,4Fe(OH)2+O2+2H2O=4Fe(OH)3,故Fe(OH)2在水中稳定存在的寿命只有几秒钟,在实验室制取Fe(OH)2时,一定要用新制的Fe2+盐和先加热驱赶O2后的NaOH溶液,且滴管末端插入试管内的液面下,再滴加NaOH溶液,也可以在反应液面上滴加植物油或苯等物质进行液封,以减少Fe(OH)2与O2接触。
例 根据下述实验装置和操作,回答有关问题.
按图中所示装置,用两种不同操作分别进行实验,观察B管中现象.
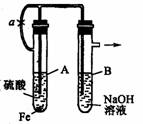
(1)操作1:先夹紧止水夹a,再使A管开始反应.实验中在B管中观察到的现象是:_____________________________________________。
氢氧化亚铁制备的化学实验:B管中发生反应的离子方程式是:____________________________。
(2)操作2:打开止水夹a,使A管开始反应一段时间后再来夹紧止水夹a.实验中在B管中观察到的现象是:____________________________________________________。
B管中发生反应的离子方程式是:_____________________________________。
(3)请说明造成两种操作现象不同的原因,(若两种现象相同,此小题不需要回答)______________________________________________。
【解析】当加紧止水夹a使A试管进行反应时,产生的气体会将稀H2SO4和生成的FeSO4压入B管内,与适量的NaOH反应生成Fe(OH)2沉淀,但由于系统中含有空气,生成的Fe(OH)2即被氧化为Fe(OH)3,www.xuexidiyi.com出现一系列的颜色变化。当先使A管内反应一段时间后再关闭止水夹,由于产生的氢气将系统中的空气赶紧,使生成的Fe(OH)2不再被氧化。
【答案】(1)液面上升,生成白色沉淀,迅速变成灰绿色,最后变成红褐色。
方程式:
(2)液面上升,生成白色沉淀;:
(3)操作1没有排出B试管中的空气,而操作2产生的氢气使试管中空气排出,防止Fe(OH)2被氧化为Fe(OH)3.
【思维启示】关于Fe(OH)2制备的方法很多,核心问题两点,一是溶液中的溶解氧必须除去,二是反应过程必须与O2隔绝。
17年高考化学一轮复习氢氧化亚铁的实验制备的全部内容就是这些,精品学习网希望对考生复习化学实验有帮助。
相关链接
标签:高考化学实验
免责声明
精品学习网(51edu.com)在建设过程中引用了互联网上的一些信息资源并对有明确来源的信息注明了出处,版权归原作者及原网站所有,如果您对本站信息资源版权的归属问题存有异议,请您致信qinquan#51edu.com(将#换成@),我们会立即做出答复并及时解决。如果您认为本站有侵犯您权益的行为,请通知我们,我们一定根据实际情况及时处理。