2016年高考理综复习方法总结:化学平衡计算突破
编辑:sx_haody
2016-01-22
世间万物讲求一个balance(平衡)。对于人,阴阳调和,方处健康;对于势力双方,博弈平衡,方能保证持续动态发展;化学反应亦是如此,可逆反应不会永无止境,其"终点"即为平衡,平衡意味着逆、等、动、定、变。精品学习网带来了2016年高考理综复习方法总结:化学平衡计算突破,看完后再仔细回味复习已学的化学平衡,加以练习,希望有所收获!
干货:
Part1化学平衡的概念关键
化学平衡状态就意味着以下几点--逆、等、动、定、变。
逆--有化学平衡,一定是可逆反应;
等--化学反应处于平衡状态时,正反应速率等于逆反应速率;
动--动态平衡,反应并没有停止,是处于动态平衡中,仍在进行;
定--反应的反应物和生成物浓度保持不变或反应中各组分的浓度、体积分数随时间变化保持不变;
变--化学平衡是有条件的平衡,在外界条件变化时,原有平衡被打破即会发生化学平衡移动,最终会建立新的平衡。
Part2化学平衡的三段式
化学平衡的计算主要类型有:
①求各种浓度--起始浓度、转化浓度、平衡浓度、过程中某一时刻点浓度;
②求各种百分比--某反应物的转化率、平衡气体混合物中某个成分的体积分数等;
而化学平衡题的计算精髓或者葵花宝典就是,三段式啦!三段式在手,打遍化学平衡计算题!以简单的为例,此专题后大家可以深入练习,举一反三。
设A物质、B物质的起始浓度为amol/L,bmol/L,反应式如下,然后A物质反应了mxmol/L,那么会得到哪些量呢?
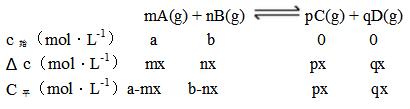
三段式,即第一段为反应的起始量,第二段为变化量,第三段为反应的平衡量(或对应某个时刻时的量),然后相关求解就对应行数列数找对应量,再计算即可。
例1:求B反应物的转化率?
根据A反应物反应了mxmol/L,由方程式的计量数比可得B反应物反应了nxmol/L,那么B反应物的转化率就是。
例2:求反应平衡时混合气体中C气体的体积分数?
根据A反应物反应了mxmol/L,由方程式的计量数比可得B反应物反应了nxmol/L,C反应物生成了pxmol/L,D反应物生成了qxmol/L,那么平衡时混合气体的总量为(a-mx+b-nx+px+qx),而C的量是px,那么C气体的体积分数就是。
注意,起始浓度、转化浓度、平衡浓度中,只有转化浓度之比等于化学方程式的计量数之比!
Part3平衡常数的计算
在三段式的基础上就很容易求出对应反应的平衡常数了,继续以上面的反应为例,则该反应的平衡常数为:(其中c(A)、c(B)、c(C)、c(D)为反应平衡时各物质浓度,即三段式第三行的量;气体也可能是对应压强)
若是反应未达到平衡,按的式子求出的是Q,通过Q与的值比较可以判断反应的限度,是未达到平衡还是已经过了平衡。
的值只与温度有关,与反应物、生成物浓度无关。
的值针对每一个具体的化学反应,化学方程式等比例变化或逆向,的值都会相对应变化,因为式子中浓度上的系数是变化了的。
另外,化学反应中若出现固体物质等情况,的表达式要有相应改变,固体物质的浓度计为1;若是固体生成气体的反应,这时候就要用气体压强比来代入计算等。
化学平衡其实属于一个较大的知识点,在此由于篇幅所限,就只简述了化学平衡中的经典三段式计算和化学平衡常数简单计算,而化学平衡移动、等效平衡和其他深入问题,请同学们自己探索或期待以后的专题!记得多多练习才能学好化学哟!
2016年高考理综复习方法总结:化学平衡计算突破就分享到这里了,一轮复习关系到高考的成败,希望上文能帮助大家做好高考第一轮复习,请继续关注精品学习网!
2016年高考第一轮复习备考专题已经新鲜出炉了,专题包含高考各科第一轮复习要点、复习方法、复习计划、复习试题,大家来一起看看吧~
标签:山西高考理综
免责声明
精品学习网(51edu.com)在建设过程中引用了互联网上的一些信息资源并对有明确来源的信息注明了出处,版权归原作者及原网站所有,如果您对本站信息资源版权的归属问题存有异议,请您致信qinquan#51edu.com(将#换成@),我们会立即做出答复并及时解决。如果您认为本站有侵犯您权益的行为,请通知我们,我们一定根据实际情况及时处理。