北京市五中高二化学试题.doc
编辑:sx_wangha
2017-11-14
【编者按】精品学习网为广大朋友整理了高二化学试题,希望对广大朋友有所帮助
一、选择题(本题共16小题,每小题3分,共计48分。在每小题列出的四个选项中,只有一项是符合题目要求的。)
1. 在pH=1的无色溶液中能大量共存的离子组是( )
A.
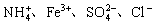
B.
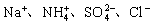
C.
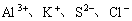
D.
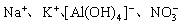
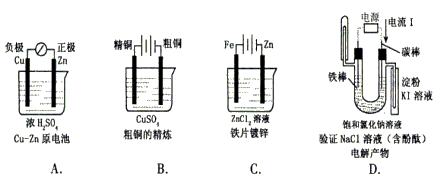
2. 下列有关电化学的图示,完全正确的是( )
3. 有下列盐:①
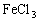
②
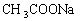
③
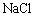
,其水溶液的pH由大到小排列正确的是( )
A. ①>③>② B. ②>③>① C. ③>②>① D. ①>②>③
4. 下列性质中,不能说明乙酸是弱电解质的是( )
A. 乙酸钠溶液显碱性
B. 常温时,0.1
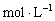
乙酸溶液的pH约为3
C. 10mL
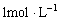
乙酸溶液与10mL
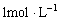
的NaOH溶液恰好完全反应
D. 在相同温度下,同物质的量浓度的乙酸溶液的导电性比甲酸溶液的弱
5. 下列说法正确的是( )
A. 在一定温度下AgCl水溶液中,
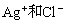
浓度的乘积是一个常数
B.
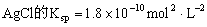
,在任何含
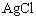
固体的溶液中,
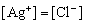
且它们浓度的乘积等于
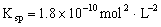
C. 温度一定时,当溶液中
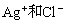
浓度的乘积等于
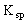
时,此溶液为AgCl饱和溶液
D. 向饱和
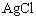
水溶液中加入盐酸,
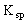
变大
6. 关于原电池和电解池的叙述正确的是( )
A. 原电池中失去电子的电极为阴极
B. 原电池的负极、电解池的阳极都发生氧化反应
C. 原电池的两极一定是由活动性不同的两种金属组成
D. 电解时电解池的阳极一定是阴离子放电
7. 密闭容器中A与B反应生成C,其反应速率分别为v(A)、v(B)、v(C)表示。已知v(A)、v(B)、v(C)之间有以下关系2v(B)=3v(A)、3v(C)=2v(B)。则此反应可表示为( )
A. 2A+3B=2C B. A+3B=2C C. 3A+B=2C D. A+B=C
8. 将pH=3的醋酸溶液和pH=11的氢氧化钠溶液等体积混合后,溶液中离子浓度关系正确的是( )
A.
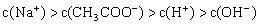
B.
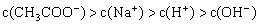
C.
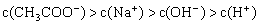
D.
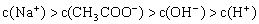
9. 向明矾溶液中逐滴加入

溶液至铝离子全部转变为
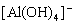
时,溶液呈( )
A. 酸性 B. 中性 C. 碱性 D. 无法比较
10. 某化学研究性小组为模拟某自然现象,设计了如图所示的装置。下列说法正确的是( )
A. 这是电解NaCl溶液的装置
B. Fe为阴极,其电极反应为:
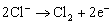
C. 这是一个原电池装置
D. Pt为正极,其电极反应为:
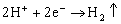
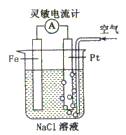
11. 在一定温度下,向aL密闭容器(容积不变)中加入1molX气体和2molY气体,发生如下反应:X(g)+2Y(g)
3Z(g)此反应达到平衡的标志是( )
A. 容器内气体的密度不随时间变化
B. 容器内各物质的浓度不随时间变化
C. 容器内X、Y、Z的浓度之比为1:2:3
D. 单位时间消耗0.1molX同时生成0.3molZ
12. 已知某可逆反应在密闭容器中进行A(s)+2B(g)
C(g)+D(g)(正反应是放热反应),图中曲线a代表一定条件下该反应的过程。若使a曲线变为b曲线,可采取的措施是( )
A. 恒温、恒容时,增大A的量
B. 恒温、恒容时,增大B的量
C. 升高温度
D. 缩小容器的容积
13. 若在铜片上镀银时,下列叙述正确的是( )
①将铜片接在电池的正极上
②将银片接在电源的正极上
③在铜片上发生的反应是:
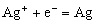
④在银片上发生的反应是:
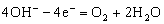
⑤需用
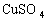
溶液
⑥需用
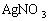
溶液作电解液
A. ①③⑥ B. ②③⑥ C. ①④⑤ D. ②③④⑥
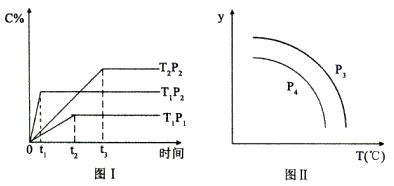
14. 在某容积一定的密闭容器中,有下列的可逆反应:A(g)+B(g)
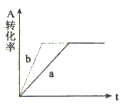
xC(g),有图I(T表示温度,P表示压强,C%表示C的体积分数)所示的反应曲线,试判断对图II的说法中正确的是( )
A.
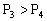
,y轴表示B的百分含量
B.
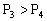
,y轴表示C的体积分数
C.
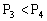
,y轴表示混合气体的密度
D.
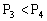
,y轴表示混合气体的平均摩尔质量
15. 用石墨电极电解硝酸银溶液,在阳极收集到0.40克氧气,中和电解时生成的酸需250毫升氢氧化钠溶液,则氢氧化钠溶液的浓度是( )
A. 0.20摩/升 B. 0.15摩/升 C. 0.10摩/升 D. 0.05摩/升
16. 已知合成氨的反应为:
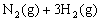
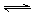
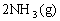
;△H=
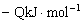
(Q>0)。在同温同压下向密闭容器甲中通入1mol
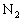
和3mol
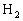
,达平衡时,放出的热量为
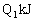
;向另一容积相同的密闭容器乙中通入0.5mol
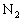
和1.5mol
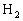
,反应达平衡时,放出的热量为
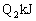
(两容器容积一定)。则下列关系正确的是( )
A.
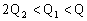
B.
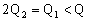
C.
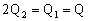
D.
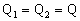
第II卷(非选择题 共52分)
二、填空题(本题包括4小题,共28分)
17. (4分)由金红石(
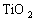
)制取单质Ti,涉及到的步骤为:
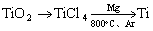
已知:①

②
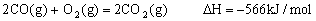
③
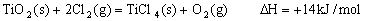
则(1)
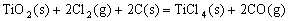
的△H=______________。
(2)碳在氧气中不完全燃烧生成CO的热化学方程式为_________________。
18. (8分)在一定体积的密闭容器中,进行如下可逆化学反应:
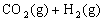
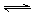
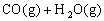
,其化学平衡常数K和温度t的关系如下表:
t℃70080083010001200
K0.60.91.01.72.6
回答下列问题:
(1)该反应的化学平衡常数表达式为K=______________。
(2)该反应为______________(反应)(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是______________(多选扣分)。
(a)容器中压强不变 (b)混合气体中C(CO)不变
(c)
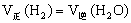
(d)
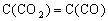
(4)某温度下,平衡浓度符合下式:
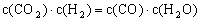
,此时的温度为______________℃。
19. (8分)已知某溶液中只存在
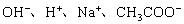
四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
①
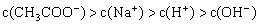
②
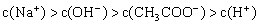
③
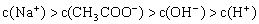
④
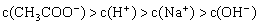
填写下列空白:(1)若溶液中溶解了一种溶质,则该溶质是______________,则该溶液中四种离子浓度的大小顺序符合上述4种关系中的______________。(填序号)
(2)若上述关系①是正确的,则溶液中的溶质为______________;若上述关系②是正确的,则溶液中的溶质为______________。
(3)若该溶液是由体积相等的NaOH溶液和醋酸混合而成,且恰好呈中性,则混合前c(NaOH) ______________c(CH3COOH)(填“大于”、“小于”、或“等于”,下同),混合后溶液中C(CH3COO-)______________C(Na+)。
20. (8分)写出下列反应的离子方程式
(1)NaxA溶液显碱性
(2)明矾溶液与Na2S溶液混合,放出臭鸡蛋气味的气体并生成白色沉淀
(3)
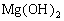
悬浊液中滴入
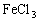
溶液
(4)
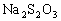
溶液与稀硫酸混合后溶液逐渐形成浅黄色浑浊液
三、实验题(本题包括2小题,共13分)
21. (5分)某学生用
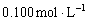
的KOH标准溶液滴定未知浓度盐酸,其操作可分解为如下几步:
A. 移取20mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞;
B. 用标准溶液润洗滴定管2~3次;
C. 把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液;
D. 取标准KOH溶液注入碱式滴定管至刻度0以上2~3cm;
E. 调节液面至0或0以下刻度,记下读数;
F. 把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度。就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)________________________。
(2)上述B步骤操作的目的是________________________。
(3)上述A步骤操作之前,先用待测溶液润洗锥形瓶,则对滴定结果的影响是________________________________________________________________________。
(4)判断到达滴定终点的实验现象是_____________________________________。
(5)若称量一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,则对滴定结果的影响是________________________。
22. (8分)已知:(A)
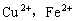
在pH值为4~5的条件下不水解而
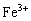
却几乎全部水解;
(B)双氧水(
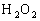
)是强氧化剂,在酸性条件下,它的还原产物是
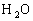
。
用粗氧化铜(CuO中含少量Fe)制取
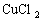
溶液过程如下:
①取50毫升纯净的盐酸,加入一定量的粗CuO加热搅拌,充分反应后过滤,经测定溶液的pH值是3
②向滤液中加入双氧水,搅拌。
③向②中加入过量纯CuO,微热,搅拌,此时测定溶液的pH值为4,过滤。
④把③所得滤液浓缩。
填空:
(I)②中发生反应的离子方程式是________________________。
(II)③中过滤后滤渣的成分是________________________。
(III)①③中如何用pH试纸测定溶液的pH值:_________________________________
________________________________________________________________________。
(IV)③中pH值升高的原因是:________________________。(用离子方程式表示)
四、计算题(本题包括2小题,共11分)
23. (5分)将pmol
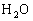
和qmolCO置于1L容器中,在一定条件下,加热至高温,发生如下可逆反应:
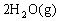
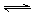
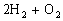
、2CO+
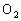
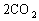
(1)当上述体系达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不可以是____________。(填下列组合的序号)
①
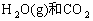
②
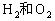
③
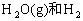
④
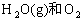
⑤
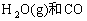
⑥
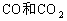
⑦
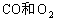
⑧
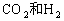
(2)若平衡时
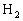
和CO的物质的量分别为
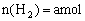
,
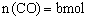
,则平衡时
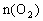
_________________。(用含a、b、p、q的代数式表示)
24. (6分)对于反应
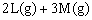
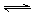
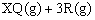
,在容积为2L的密闭容器中,将2mol气体L和3mol气体M混合,当反应经2分钟后达平衡时,生成2.4mol气体R,并测得Q的浓度为0.4mol/L,求:
(1)X的值是多少?
(2)L的转化率是多少?
(3)M的反应速率
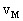
是多少?
标签:高二化学试题
免责声明
精品学习网(51edu.com)在建设过程中引用了互联网上的一些信息资源并对有明确来源的信息注明了出处,版权归原作者及原网站所有,如果您对本站信息资源版权的归属问题存有异议,请您致信qinquan#51edu.com(将#换成@),我们会立即做出答复并及时解决。如果您认为本站有侵犯您权益的行为,请通知我们,我们一定根据实际情况及时处理。